Titrationskurven – Starke Säure

Titrationen werden im Chemiealltag sehr häufig durchgeführt. Dies liegt daran, dass eine Titration zur Bestimmung der Konzentration einer beliebigen Lösung verwendet werden kann. Die Einsatzmöglichkeiten sind daher grenzenlos! Damit also auch du bei deiner nächsten Chemieklausur genau weißt, wie eine Titrationskurve entsteht und was diese aussagt, betrachten wir dieses Thema einmal genauer.
Um eine Titrationskurve erstellen zu können, müssen wir vorerst ein Experiment durchführen. In unserem Fall führen wir eine Titration mit einer starken Säure (Salzsäure) und einer starken Base (Natronlauge) durch. Demzufolge wird unsere Titrationskurve die Änderung des pH-Wertes der Lösung anzeigen. Falls du vorerst noch mehr Informationen zum Thema starke Säure benötigst, geh zu meinem Blogbeitrag „Starke und schwache Säure?“.
Für das Experiment befestigen wir nun eine Bürette mithilfe eines Stativs über einem Becherglas, welches auf einem Magnetrührer steht. Die Bürette befüllen wir dann mit 50 mL Natronlauge und in das Becherglas geben wir 20 mL Salzsäure. Damit wir im Verlauf der Titration den Unterschied im pH-Wert messen können, verwenden wir außerdem ein pH-Messgerät und einen Indikator (Bromthymolblau). Dieser Indikator ist in saurer Lösung gelb, bei einem pH-Wert von 7 (neutrale Lösung) grün und in alkalischer Lösung blau.

Um folglich unsere Titrationskurve zu erstellen, tropfen wir nach und nach wenige Milliliter der Natronlauge in unser Becherglas. Die Messwerte notieren wir dann in einer Wertetabelle, wobei wir jedem Volumen an zugegebener Natronlauge einen pH-Wert zuordnen.
Während des Experiments ist Folgendes zu beobachten: Zu Beginn des Versuchs bleibt die Lösung stetig gelb und dementsprechend ist auch der pH-Wert kleiner als 7. Bei ungefähr 20 mL zugegebener Natronlauge springt der pH-Wert schlagartig auf ungefähr pH = 7 an und die Lösung färbt sich grün. Wenige Tropfen später schlägt der pH-Wert erneut um und die Lösung wird blau. Ab dann steigt der pH-Wert nur noch langsam weiter an, bis dieser sich bei ungefähr pH = 13 einpendelt.

Aus den Messwerten ergibt sich folgende Titrationskurve:
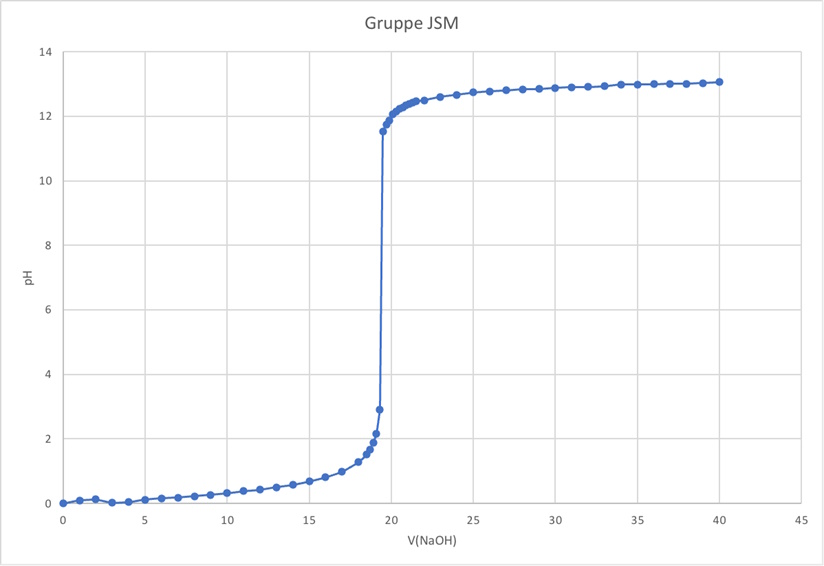
Anhand der Titrationskurve der starken Säure wird sichtbar, dass die starke Säure und die starke Base sich bei ungefähr 20 mL zugegebener Base ausgleichen. Dies wird als Äquivalenzpunkt bezeichnet und zeigt an, an welchem Punkt die Konzentration beider Lösungen identisch ist. Außerdem kann am Anfangspunkt die Konzentration der Säure bestimmt werden, da bei 0 mL zugegebener Base ausschließlich die Säure im Becherglas enthalten ist. Bei einem pH-Wert von 0 ist die Konzentartion dementsprechend c = 1 mol/L. Darüber hinaus ist diese Titrationskurve für alle starken Säuren charakteristisch. Das bedeutet, dass auch allein anhand der Titrationskurve Aussagen über die Säurestärke und der Konzentration getroffen werden kann.
Wie ihr sicherlich merkt, kann man mithilfe einer Titrationskurve Vieles bestimmen und erklären. Und von nun an wisst ihr auch, sobald ihr eine Titrationskurve seht, die aussieht wie ein umgedrehtes Z, dass es sich sehr wahrscheinlich, um eine starke Säure handelt. Das ist doch leicht zu merken!