Kältekompresse

Einige kennen es wahrscheinlich: Beim Fußballtraining oder in der Vorbereitung fürs nächste Volleyball-Spiel hat man es mit dem Ehrgeiz etwas zu sehr übertrieben und sich dabei eine Sportverletzung zugezogen. Doch natürlich ist diese Verletzung so heftig, dass nun der Griff zur portablen Mini-Apotheke nötig ist, um akute Erste-Hilfe zu leisten. Hierbei kommt besonders ein kleiner Helfer immer wieder zum Einsatz: die Sofort-Kältekompresse.
Doch warum erzähle ich euch das? Nun, im Chemieunterricht in der 12. Klasse behandeln wir momentan das Thema „Reaktionsenthalpien von chemischen Reaktionen“. Die Enthalpie ist dabei nichts anderes als die Wärme, die bei einer chemischen Reaktion an die Umgebung abgegeben wird bzw. von der Umgebung aufgenommen wird. Ein kleiner Unterbereich dieses Themas, welchen die 12er ebenfalls im Chemieunterricht behandelt haben, ist die Lösungsenthalpie, also die Enthalpie bei der Lösung von Salzen in Wasser. In diesem Rahmen haben wir versucht experimentell zu ermitteln, ob ein Lösevorgang exotherm oder endotherm abläüft. Doch nun wollen wir uns darüber hinaus noch damit beschäftigen, wie sich solche Energieumsätze praktisch in den Alltag integrieren lassen. Und genau hierfür eignet sich das Beispiel der Kältekompresse.
Wie funktioniert sie?
Die Kältekompresse ist ein kleiner Beutel, dessen Inhalt aus zwei Stoffen besteht. Der eine Stoff ist ein Feststoff, in unserem Fall Urea (Harnstoff), der andere ist Wasser. Dabei befinden sich die beiden Stoffe separiert in dem Beutel der Kältekompresse, was verhindern soll, dass der Lösevorgang ungewollt von Statten geht. Wenn es nun zum medizinischen Notfall kommt und die Kältekompresse gebraucht wird, versucht man mit den Fingern den kleinen Beutel, in dem das Wasser enthalten ist, zu durchstoßen, ohne dabei die Kältekompresse selbst zu beschädigen. Das austretende Wasser mischt sich dann mit dem Feststoff und löst diesen. Dabei entsteht in der Kältekompresse eine Lösung, die den gewünschten abkühlenden Effekt erzeugt.
Genau dieser Lösevorgang soll uns nun näher interessieren. Denn es reicht uns nicht, nur lediglich festzustellen, dass die Lösung sich abkühlt. Wir wollen es genau wissen, wieviel Wärme von der Lösung aufgenommen wird, sprich wie hoch die Enthalpie ausfällt. Doch um das herauszufinden, müssen wir ein Experiment durchführen, welches einigen bereits aus dem Chemieunterricht der 12. Klasse bekannt ist.
Wie führe ich das Experiment durch?
Für das Durchführen des besagten Experimentes benötigt es ein Kalorimeter. Das Kalorimeter besteht aus einem größtenteils isolierten System, sprich ein Behälter, der mit Styropor ummantelt ist, ein Thermometer zur Temperaturbestimmung und Wasser, welches sich im Behälter befindet. Zudem kann man noch einen Glasstab oder Ähnliches zum Umrühren bereitlegen. Manchmal benötigt man noch mehr Utensilien, z. B. wenn man eine andere Art von chemischer Reaktion durchführt, wie etwa eine Verbrennungsreaktion etc., doch in unserem Fall genügen diese Gegenstände.
Zu guter Letzt benötigen wir noch die Stoffe, die gleich miteinander reagieren sollen, und zwar den Harnstoff und das Wasser. Beide Zutaten entnehmen wir der Kältekompresse. Dafür schneiden wir die Kältekompresse vorsichtig auf und entnehmen geschickt die beiden Stoffe. Den Harnstoff und das Wasser, welche wir vorher noch aus ihrer Verpackung entnehmen müssen, füllen wir jeweils in einen kleinen Behälter. Dann nehmen wir uns eine Waage zur Hand und wiegen einzeln die beiden Stoffe. Dabei kommt heraus, dass der Harnstoff eine Masse von 72,1 g besitzt und das Wasser eine Masse von 32 g. Den Wert der Wassermassesollten wir dabei im Hinterkopf behalten, da wir diesen später noch brauchen.
Nun da wir alle Vorkehrungen getroffen haben, können wir das Experiment endlich starten. Dafür nehmen wir das Wasser aus der Kältekompresse und füllen es in den isolierten Behälter. Bevor wir aber den Harnstoff Salz hinzugeben, messen wir mit dem Thermometer zuerst noch die Temperatur des Wassers. Den dabei erhaltenen Wert von 21 °C notieren wir uns ebenfalls. Jetzt können wir den Harnstoff in das Wasser hinzugeben und mit dem Glasstab gut umrühren, um sicherzugehen, dass wirklich alles von dem Wasser gelöst wird. Nachdem der Lösevorgang vollendet ist, nehmen wir wieder das Thermometer und messen die Temperatur der Lösung. Auch den daraus erhaltenen Wert von 3 °C notieren wir uns.
Wie bestimme ich damit die Enthalpie?
Jetzt, nachdem wir alle für uns relevanten Werte zur Bestimmung der Enthalpie der Lösung aus dem Experiment zusammengetragen haben, kommt der mathematische Teil. Unsere Werte können wir nämlich in eine Formel einsetzten, mit der wir die Enthalpie bestimmen können. Bei dieser Formel handelt es sich um die Kalorimetergleichung, die wie folgt aussieht:
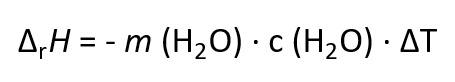
Die Masse m (H2O) kennen wir noch, sie lautet 32 g. Wir müssen sie lediglich in die Standardeinheit kg umrechnen, also m (H2O) = 0,032 kg. Die spezifische Wärmekapazität c des Wassers ist ein bereits gegebener Wert, den wir beispielsweise aus dem Tafelwerk entnehmen können. Sie lautet 4,186 kJ kg-1 K-1. Zu guter Letzt brauchen wir noch die Änderung der Temperatur des Wassers in dem Kalorimeter, in unserem Experiment waren das -18 K. Nun können wir alle Werte in die Formel einsetzen und erhalten 2,4 kJ als Ergebnis. Diese 2,4 kJ werden der Umgebung entzogen, deshalb wird es kalt. Aber eigentlich wussten wir das schon vorher, denn dass sich die Kältekompresse abkühlt, sagt ja bereits schon der Name aus.
Aber nun wisst ihr genau, mit welcher Enthalpie euch die Kältekompresse Abkühlung verschafft. Wobei zugegeben, der Wert der Enthalpie ist nicht ganz genau, weil die Kalorimeter aus der Schule doch kleine Fehler aufweisen und man genauere bräuchte, um exakte Werte ermitteln zu können. Trotzdem geben sie uns noch akzeptable Werte, an denen man sich orientieren kann.